Kemudahan suatu molekul untuk membentuk
dipol sesaat atau untuk menginduksi (mengimbas) suatu dipol disebut
polarisabilitas (keterpolaran).
Polarisabilitas ini berkaitan dengan
massa molekul relatif (Mr) dan bentuk molekul. Pada umumnya,
makin banyak jumlah elektron, makin mudah mengalami polarisasi. Karena jumlah
elektron berkaitan dengan Mr,
maka semakin besar Mr,
semakin kuat gaya London. Gaya dispersi London ini termasuk gaya yang relatif
lemah, karena interaksi yang terjadi adalah antar molekul nonpolar. Contoh
molekul yang mengalami gaya london diantaranya: gas hidrogen, gas nitrogen,
metana dan gas-gas mulia.
Gaya London merupakan gaya tarik menarik antara molekul-molekul non polar. Gaya London juga merupakan bagian dari gaya antar molekul yang terjadi antara molekul polar dengan molekul non polar, serta antara molekul polar dengan polar.
Terjadinya
Gaya London antara molekul-molekul mono atomik terjadi karena elektron selalu
dalam keadaan bergerak maka pada suatu saat yang singkat dapat terjadi
polarisasi rapatan elektron. Bentuk awan elektron dianggap mengalami devisiasi
dari simentri bola. Molekul dikatakan memiliki dipol sesaat (Instataneous
dipol) atau dipol sekejap.
Apabila
dua molekul mono atomik non polar dengan elektron-elektron dalam
kedudukan simetris saling mendekati, maka terjadi gaya tarik inti molekul
sebelah kanan terhadap elektron-elektron terhadap molekul sebelah kiri sehingga
kedudukan elektron pada molekul sebelah kiri tidak lagi simetris dan padanya
terjadi dipol sesaat. Pada saat kondisi tersebut awan elektron molekul kiri
tidak lagi memiliki simentri bola.
Gambar terjadinya gaya london
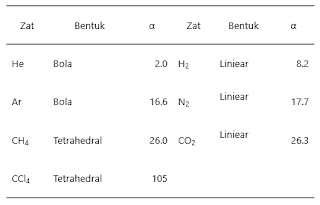
Faktor
Gaya London
Jumlah
elektron dalam suatu molekul berbanding lurus dengan massa molekulnya oleh
karena itu kebolehpolaran suatu molekul semakin tinggi dengan bertambahnya
massa molekulnya. Kenaikan kebolehpolaran molekul menyebabkan semakin mudahnya
molekul tersebut membentuk dipol sesaat dan dipol induksian sehingga Gaya
London yang yang terjadi kuat.
Dipol
Induksian
Momen
dipol sesaat akan hilang tetapi lalu timbul kembali secara terus menerus dan
bergantian. Apabila di dekatnya ada molekul non polar maka molekul dengan dipol
sesaat ini akan menginduksi molekul tersebut sehingga terjadi dipol induksian (induced
dipol). Setelah dua molekul tersebut membentuk dipol sesaat dan dipol
induksian, maka keduanya terjadi gaya tarik elektro magnetik yang disebut Gaya
London.
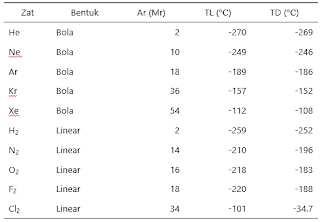
Titik
Lebur (TL) dan Titik Leleh (TL) Beberapa Zat
Daftar
Pustaka

Terima kasih materinya ,sangat membantu.
BalasHapusTerima kasih telah berkunjung, jangan lupa lihat materi tentang kimia organik fisik yang lainnya ya.
HapusTerima kasih atas materinya yang sangat bermanfaat sekali
BalasHapusTerima kasih atas materinya yang sangat bermanfaat sekali
BalasHapussenang dapat membantu, jangan lupa berkunjung ke thread yang lainnya ya, terima kasih telah berkunjung.
HapusTerima kasih atas penjelasannya sangat bermanfaat dan lengkap
BalasHapussenang dapat membantu, jangan lupa berkunjung ke thread yang lainnya ya, terima kasih telah berkunjung.
HapusMateri yang bermanfaat, terimakasih banyak
BalasHapusSenang materi yang dipaparkan dapat bermanfaat. jangan lupa kunjungi thread lainnya di blog ini yaa, terima kasih telah berkunjung.
HapusTerima kasih atas materinya sangat bermanfaat
BalasHapusterima kasih telah berkunjung, senang materinya dapat bermanfaat, jangan lupa kunjungi thread lainnya ya, bila ada kendala dapat ditanyakan.
Hapusbagaimana proses polarizablitas dengan gaya london bisa terjadi ?
BalasHapus