Bagi kebanyakan
senyawa, semua molekul mempunyai struktur yang sama, apakah struktur tersebut
dapat memuaskan atau tidak dinyatakan dengan struktur Lewis. Tetapi ada juga
senyawa lain yang ada dalam satu campuran dari dua atau lebih senyawa yang
secara struktural berbeda, dan campuran berada dalam kesetimbangan yang cepat.
Jika fenomena ini (disebut tautomeri) ada maka ada pergeseran bolak-balik yang
cepat antara molekul-molekul yang kesetimbangan tersebut. Di dalam peristiwa
ini ada proton yang berpindah dari satu atom dalam satu molekul ke atom yang
lain menjadi molekul lain.
Tautomeri keto-enol
Bentuk tautomeri yang
paling umum adalah tautomeri antara senyawa karbonil yang mengandung hidrogen-α
dengan bentuk enolnya.
Di dalam hal yang
sederhana (R” = H, alkil, OR, dst), kesetimbangan terletak di sebelah kiri.
Alasan untuk itu dapat diuji melalui energi ikat. Bentuk keto berbeda dari
bentuk enol dalam hal pemilikan ikatan C-H, C-C, dan C=O, di mana enol
mempunyai ikatan C=C, C-O, dan O-H. Jumlah energi ikat untuk deret tiga ikatan
yang pertama di atas adalah 360 kkal/mol dan untuk deret yang kedua adalah 345
kkal/mol. Bentuk keto lebih stabil sekitar 15 kkal/mol. Jika R mengandung
ikatan rangkap yang dapat berkonjugasi dengan ikatan rangkap enol, jumlah enol
menjadi besar dan bahkan bisa menjadi dominan. Ester mempunyai enol yang lebih
banyak daripada keton. Di dalam molekul seperti asetoasetat, enol juga
distabilkan oleh ikatan hidrogen internal, yang mana ikatan ini tidak tersedia
dalam bentuk keto:
Sering kali jika
kandungan enolnya tinggi maka kedua bentuk dapat diisolasi. Bentuk keto ester
asetoasetat murni meleleh pada -39oC sedangkan bentuk
enolnya adalah cairan dengan titik leleh -78oC. masing-masing
dapat disimpan selama beberapa hari jika katalisator seperti asam atau basa
benar-benar telah dikeluarkan. Bahkan enol paling sederhana yakni vinil alkohol
CH2=CHOH telah dibuat dalam fase gas pada suhu kamar, dan enol ini
mempunyai waktu paruh sekitar 30 menit.
Tabel kandungan enol beberapa senyawa karbonil
Keberadaan enol
sangat dipengaruhi oleh pelarut, konsentrasi, dan suhu. Ester asetoasetat
mempunyai kandungan enol 0,4% dalam air dan 19,8% dalam toluena. Dalam hal ini,
air mengurangi konsentrasi enol melalui pembentukan ikatan hidrogen dengan
karbonil sehingga gugus tersebut kurang bersedia membentuk ikatan hidrogen
internal.
Jika ada basa kuat,
kedua bentuk enol dan keto dapat kehilangan proton. Anion yang dihasilkan
keduanya adalah sama. Oleh karena 19 dan 20 hanya berbeda dalam
hal penempatan elektron maka keduanya bukanlah tautomer, tapi bentuk kanonik.
Struktur ion enolat yang sebenarnya adalah hibrida dari 19 dan 20, meskipun
20 lebih banyak berkontribusi karena di dalam bentuk ini muatan negatif
ada pada atom yang lebih elektronegatif.
Tautomeri pergeseran proton yang lain
Di dalam semua hal,
anion hasil dari pelepasan sebuah proton dari masing-masing tautomer adalah
sama karena resonansi. Beberapa contoh adalah:
1. Tautomeri fenol-keto.
Bagi fenol yang
paling sederhana, di dalam setimbangan ini terletak pada sisi fenol karena
hanya pada sisi ini terdapat kearomatikan. Bagi fenol sendiri, tidak ada fakta
untuk keberadaan bentuk keto. Meskipun demikian, bentuk keto menjadi penting
dan mungkin dominan apabila: (1) adanya gugus tertentu, seperti gugus OH kedua atau
gugus N=O, (2) dalam sistem aromatik yang dipadukan, dan (3) di dalam sistem
heterosiklik. Bagi kebanyakan senyawa heterosiklik dalam fase cair atau dalam
larutan, bentuk keto adalah bentuk yang lebih stabil; meskipun di dalam fase
uap, posisi kesetimbangan menjadi berbalik. Sebagai contoh, di dalam
kesetimbangan antara 4- pidone 21 dengan 4-hidroksipiridin 22,
hanya bentuk 21 yang terdeteksi jika dalam larutan etanol, sedangkan 22
dominan dalam fase uap.
2. Tautomeri nitroso-oksim.
Letak kesetimbangan
ini jauh ke kanan; dan sebagai aturan, senyawa nitroso stabil hanya jika ada
ikatan hidrogen-α.
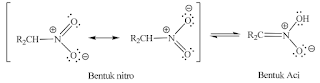
3. Senyawa nitro alifatik berada dalam kesetimbangan dengan
bentuk aci.
Bentuk nitro jauh
lebih stabil daripada bentuk aci, hal ini sangat bertentangan dengan tautomeri
nitroso-oksim karena tidak disangsikan lagi bentuk nitro mempunyai resonansi
yang tidak ditemukan dalam tautomeri nitroso.
4. Tautomeri imina-enamina.
Enamina secara normal
stabil hanya jika tidak ada hidrogen pada nitrogen (R2C=CR-NR2). Kalau tidak
demikian maka bentuk imina yang dominan.
Daftar Pustaka
Firdaus. 2009.
Modul Kimia Organik Fisis I. Makassar: Unhas Press.








Terima kasih atas materinya yang sangat bermanfaat sekali
BalasHapusTerima kasih telah berkunjung.
HapusUdah oke itu, sudah dikasih contoh.
BalasHapusLabih bagus kalau referensi ditambah.
Terima Kasih telah berkunjung serta sarannya, semoga bermanfaat.
Hapus