Dalam
suatu ikatan kovalen tunggal dari atom yang tak sejenis, pasangan electron yang
membentuk ikatan sigma, tidak pernah terbagi secara merata di antara kedua
atom. Electron memiliki kecenderungan untuk tertarik sedikit ataupun banyak kea
rah atom yang lebih elektronegatif dari keduanya. Misalnya dalam suatu alkil
klorida, kerapatan electron cenderung lebih besar pada daerah didekat atom Cl
daripada atom C. sebagai penunjuk bahwa atom yang satu lebih elektronegatif,
secara umum dituliskan sebagai berikut:
Jika
atom karbon terikat pada klorin dan ia sendiri berikatan pada atom karbon
selanjutnya, efek induksi dapat diteruskan pada karbon tetangganya.
Akibat
dari pengaruh atom klorin, electron pada ikatan karbon klorin didermakan
sebagian ke klorin, sehingga menyebabkan C1 sedikit kekurangan electron.
Keadaan C1 ini menyebabkan C2 mesti mendermakan juga sebagian elektronnya pada
ikatan C2 dengan C1 agar menutupi kekurangan electron di C1. Begitu seterusnya.
Namun, efek ini dapat hilang pada suatu ikatan jenuh (ikatan rangkap), efek
induktif ini juga semakin mengecil jika melewati C2. Pengaruh distribusi
electron pada ikatan sigma ini dikenal sebagai efek induksi.
Sebagai perbandingan relatifitas efek induksi,
kita memilih atom hydrogen sebagai molekul standarnya, misalnya CR3-H.
- Jika ketika atom H dalam molekul ini diganti
dengan Z (atom ataupun gugus), kemudian kerapatan electron pada bagian CR3 pada
molekul ini berkurang daripadadalam CR3-H, maka Z dapat dikatakan
memiliki suatu efek – I (efek penarik electron / electron-withdrawing /
electron-attracting). Contoh gugus dan atom yang memiliki efek – I: NO2,
F, Cl, Br, I, OH, C6H5-.
- Jika kerapatan electron dalam CR3 bertambah
besar dari pada dalam CR3-H, maka Z dikatakan memiliki efek + I (efek
pendorong electron / electron-repelling / electron-releasing). Contoh gugus dan
atom yang memiliki efek + I: (CH3)3C-, (CH3)2CH-,
CH3CH2-, CH3-.
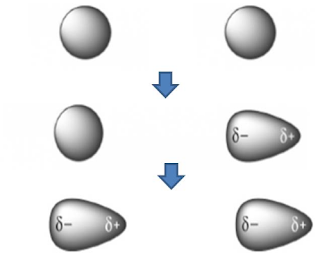
Ikatan C-C dalam etana adalah nonpolar sempurna karena ikatan
tersebut menghubungkan dua atom yang ekuivalen. Akan tetapi ikatan C-C dalam
kloroetana terpolarisasi oleh adanya atom klor elektronegatif. Polarisasi ini
sebenarnya adalah jumlah dari dua efek. Pertama, atom C-1 telah kekurangan
sejumlah kerapatan elektronnya oleh elektronegativitas Cl yang lebih besar,
diganti secara parsial oleh ikatan C-C yang ada didekatnya mengakibatkan
polarisasi ikatan ini dan suatu muatan positif kecil pada atom C-2. Polarisasi
satu ikatan yang disebabkan oleh polarisasi ikatan tetangga disebut efek
induksi. Efek ini tidak hanya dirasakan oleh ikatan tetangga, namun dapat pula
berpengaruh sampai ikatan yang lebih jauh. Efek ini berkurang dengan
bertambahnya jarak. Polarisasi ikatan C-C menyebabkan pula sedikit polarisasi
tiga ikatan C-H metil.
Resonasi dan induksi tidak perlu bekerjanya dalam arah yang sama.
Di dalam keadaan dasar (ground state) efek-efek ini bekerja secara permanen dan
dapat nyata dalam sejumlah sifat-sifat molekul. Salah hal yang paling ideal
yang berhubungan dengan efek induksi adalah kecepatan solvolisis
4-(4-alkilbisiklo[2.2.2]oktan-1-ilbrosilat dalam asam asetat pada 75oC.
Kecepatan relatif diberikan sebagai berikut:
Gugus fungsi dapat dikelompokkan sebagai gugus penarik
elektron (-I) dan gugus pendorong elektron (+I) relatif terhadap
atom hidrogen. Sebagai contoh gugus nitro adalah suatu gugus –I, gugus ini
lebih kuat menarik elektron ke dirinya daripada atom hidrogen.
Di dalam α-nitrotoluena, elektron di dalam ikatan C-N lebih jauh
dari atom karbon daripada elektron di dalam ikatan H-C toluena. Hal yang
serupa, elektron ikatan C-Ph lebih jauh dari cincin daripada di dalam toluena.
Dengan digunakan atom hidrogen sebagai pembanding, gugus NO2 adalah gugus
penarik elektron (-I) dan gugus O- adalah gugus pendorong elektron (+I).
Meskipun demikian, tidak ada pemberian atau penarikan yang benar-benar terjadi,
hanya karena ini istilah ini nyaman digunakan; di sini hanya terjadi perbedaan
posisi elektron yang disebabkan oleh perbedaan elektronegativitas antara H
dengan NO2 atau antara H dengan O-.
Tabel berikut memuat sejumlah gugus –I dan +I yang
paling umum, dan terlihat bahwa dibandingkan dengan hidrogen, kebanyakan gugus
adalah penarik elektron. Gugus yang bersifat pendorong elektron hanya gugus
dengan muatan formal negatif (tidak semuanya demikian), atom-atom
berlektronegatif rendah seperti Si, Mg, dan sebagainya, dan kemungkinan juga
gugus alkil. Gugus alkil biasanya dipandang sebagai gugus pendorong elektron,
tapi akhir-akhir ini sejumlah contoh yang ditemukan mengarah pada kesimpulan
bahwa gugus bersifat penarik elektron dibanding dengan hidrogen.
Daftar Pustaka
Firdaus. 2009. Modul Kimia Organik Fisis I.
Makassar: Unhas Press.
Efek Induksi dan Mesomeri | ChemiPharm
Efek Induksi dan Mesomeri | ChemiPharm