Secara umum, Kimia
Organik Fisik adalah sebuah pembelajaran mengenai reaksi-reaksi fisik yang
terjadi dalam suatu senyawa organik. Berikut beberapa konsep yang terdapat
dalam kimia organik fisik:
1. Elektronegativitas
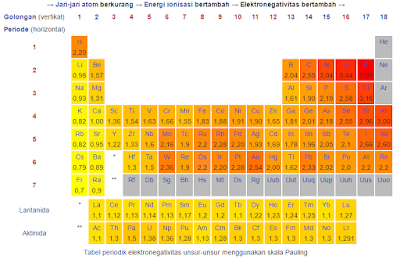
Elektronegativitas atau keelektronegatifan (Simbol:
χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuahgugus fungsi) untuk menarik elektron (atau rapatan elektron)
menuju dirinya sendiri pada ikatan kovalen.Konsep elektronegativitas pertama
kali diperkenalkan oleh Linus Pauling pada
tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi.
Elektronegativitas tidak bisa dihitung secara langsung, melainkan harus
dikalkulasi dari sifat-sifat atom dan molekul lainnya. Beberapa metode
kalkulasi telah diajukan. Walaupun pada setiap metode terdapat perbedaan yang
kecil dalam nilai numeris elektronegativitasnya, semua metode memiliki tren periode yang
sama di antara unsur-unsur. Elektronegativitas merupakan salah satu sifat
periodisitas unsur, selain afinitas elektron, jari-jari atom, dan energi ionisasi.
Metode yang umumnya sering digunakan adalah metode Pauling. Hasil
perhitungan ini menghasilkan nilai yang tidak berdimensi dan
biasanya dirujuk sebagaiskala Pauling dengan skala relatif yang berkisar
dari 0,7 sampai dengan 4,0 (hidrogen = 2,2). Bila metode perhitungan lainnya
digunakan, terdapat sebuah konvensi (walaupun tidak diharuskan) untuk
menggunakan rentang skala yang sama dengan skala Pauling: hal ini dikenal sebagai
elektronegativitas dalamsatuan Pauling.
Elektronegativitas bukanlah bagian dari sifat atom,
melainkan hanya merupakan sifat atom pada molekul. Sifat pada atom tunggal yang setara dengan
elektronegativitas adalah afinitas elektron. Elektronegativitas pada sebuah unsur akan
bervariasi tergantung pada lingkungan kimiawi, namun biasanya dianggap sebagai sifat yang
terpindahkan, yaitu sebuah nilai elektronegativitas dianggap akan
berlaku pada berbagai situasi yang bervariasi.
2. Polarizabilitas
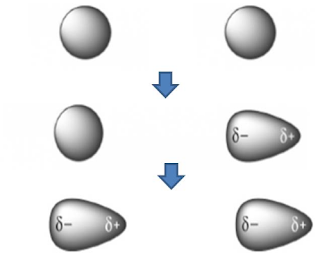
Polarizabilitas adalah pergerakan
elektron yang mengakibatkan dipol sesaat dalam suatu molekul Polarisabilitas ini berkaitan dengan massa molekul relatif (Mr) dan
bentuk molekul. Pada umumnya, makin banyak jumlah elektron, makin mudah
mengalami polarisasi. Karena jumlah elektron berkaitan dengan Mr, maka semakin besar Mr, semakin kuat gaya London. Gaya dispersi London
ini termasuk gaya yang relatif lemah, karena interaksi yang terjadi adalah
antar molekul nonpolar. Contoh molekul yang mengalami gaya london diantaranya:
gas hidrogen, gas nitrogen, metana dan gas-gas mulia.
3. Ikatan Hidrogen
Ikatan hidrogen adalah gaya tarik menarik yang
lemah antara atom elektronegatif (seperti atom fluor, oksigen, atau nitrogen,
dan atom hidrogen) terikat pada atom elektronegatif lain. Ikatan hidrogen
bertanggung jawab atas sifat yang dimiliki air dan banyak molekul biologis
lainnya.
4. Gaya Van der Waals
Gaya Van Der Waals merupakan gaya tarik
menarik listrik yang relatif lemah akibat kepolaran molekul yang permanen atau terinduksi
(tidak permanen). Kepolaran permanen terjadi akibat
kepolaran ikatan dalam molekulnya, sedangkan kepolaran tidak permanen terjadi
akibat molekulnya terinduksi oleh
partikel lain yang bermuatan sehingga molekul bersifat polar sesaat secara spontan. Gaya Van Der Waals
dapat terjadi antara partikel yang sama atau berbeda. Karena Ikatan Van Der Waals muncul
akibat adanya kepolaran, maka semakin kecil kepolaran molekulnya maka gaya Van Der Waalsnya
juga akan makin kecil.
5. Gugus Fungsi
Gugus fungsi adalah atom atau kelompok atom yang paling
menentukan sifat suatu senyawa
a. Gugus Fungsi – OH ( Alkohol )
b.
Gugus Fungsi – O – ( Eter )
Mempunyai
struktur R – O – R , Salah satu eter yaitu dietil eter ( C2Hs – O – C2Hs ).
Digunakan sebagai obat bius. Penggunaan lain dari eter adalah sebagai pelarut.
c. Gugus fungsi – C – H atau – CHO ( Aldehida )
Contohnya
adalah metanol atau formaldehida tang terdapat dalam formalin. Bahan yang
digunakan untuk mengawetkan preparat biologi atau mayat
d. Gugus Fungsi – CO – ( Keton )
Contohnya
adalah aseton, suatu cairan yang biasa digunakan para wanita untuk membersihkan
cat kuku
e. Gugus Fungsi – COOH ( Asam karboksilat )
Contohnya
adalah asam asetat ( CH3CooH ) yang terdapat dalam cuka makan.
f. Gugus Fungsi – CooR ( Ester )
Yang
banyak digunakan sebagai essen, lemak dan minyak juga tergolong Es
g. Gugus Fungsi – X ( Halogen )
Disebut
juga Haloalkana. Gugus X adalah atom Halogen yaitu F, Cl, Br atau I.
Monohaloalkana di sebut juga alkil Halida. Haloalkana di gunakan sebagai bahan
dasar pembuatan plastik dan sebagai pelarut. Contoh, Freon yang digunakan
sebagai fluida kerja dalam mesin pendingin.
DAFTAR PUSTAKA
http://fungsi.web.id/2015/10/pengertian-ikatan-hidrogen.html
https://id.wikipedia.org/wiki/Elektronegativitas

Terimakasih atas materinya. Bagaimana suatu senyawa mengalami polarisabilitas?
BalasHapusterima kasih pertanyaannya. polarisabilitas dapat terjadi bila suatu unsur yang memiliki kepolaran tinggi serta memungkinkan melepas proton, akan menari unsur yang memiliki keelektronegatifan yang tinggi, akibatnya akan terjadi peristiwa tarik-menarik elektron yang disebabkan oleh gaya elektromagnetik.
Hapusterimakasih untuk ulasan Anda..
BalasHapussaya mau bertanya, pada elektronegatifitas yang Anda paparkan. faktor-faktor apa saja yang mempengaruhi dan jelaskan.